Nature子刊:施一公团队解析抗癌临床药物抑制γ-分泌酶的分子基础
来源:生物世界 2024-12-15 10:45
该研究报道了γ-分泌酶分别结合5种进入临床试验的γ-分泌酶抑制剂(GSI)的原子分辨率结构。
γ-分泌酶是由Presenilin(PS)、PEN-2、APH-1和Nicastrin四种亚基共同组成的膜内蛋白酶复合物。由于其切割产生的淀粉样多肽在阿尔茨海默病 (Alzheimer’s disease,AD)发病过程中发挥着重要作用,以γ-分泌酶为靶点的药物设计备受关注。遗憾的是,目前靶向γ-分泌酶的AD药物无一例外地均以失败告终。另一方面,γ-分泌酶也可以水解切割Notch蛋白家族的四种亚型(Notch1-4),而Notch信号通路在多种癌症中的存在异常的激活。因此,已有多种γ-分泌酶抑制剂(γ-secretase inhibitors,GSI)进入癌症的临床试验,截至2023年4月,已有6种GSI被广泛应用于72项针对不同癌症类型的临床试验中。
值得探讨的是,这6种GSI在临床试验中有不同的表现,有的药物因效果不佳而被迫终止,有的药物仍在继续试验中,而其中一种GSI Nirogacestat已被FDA批准【 4】。那么什么因素决定了这些小分子在临床试验中的不同表现?如何对这些药物进行合理改造从而提高其治疗效果?为了回答这些问题,需要利用生物化学、结构生物学以及药物化学的方法,对每一种小分子抑制剂的抑制效果和识别机制进行系统地研究和比较,从而找到决定其抑制效果或临床表现的因素,为下一代药物的优化和设计提供基础。
2024年12月9日,西湖大学/清华大学施一公/周瑞课题组在 Nature 子刊 Nature Structural & Molecular Biology 上发表题为:Structural basis of human γ-secretase inhibition by anticancer clinical compounds 的研究论文。
该研究报道了γ-分泌酶分别结合5种进入临床试验的γ-分泌酶抑制剂(GSI)(RO4929097、Crenigacestat、BMS906024、Nirogacestat和MK-0752)的原子分辨率结构。这些GSI均占据着PS1中底物β-strand的结合口袋,但是在详细的识别模式上却各有不同。

该这项最新研究中,研究团队首先建立了Notch1-4的体外切割实验,分析5种小分子药物的抑制效果,如表1(IC50 for Notch1)所示。值得一提的是,其中三种GSI(Crenigacestat, BMS906024和Nirogacestat)具有优于其他两种药物的抑制能力,而这三种GSI恰好在临床试验中表现更佳,均有相关的临床试验在测试中。因此,作者推测更高的抑制效果可能代表更好的临床表现。那么接下来需要确认的是什么因素决定了这三种小分子具有更好的抑制效果。
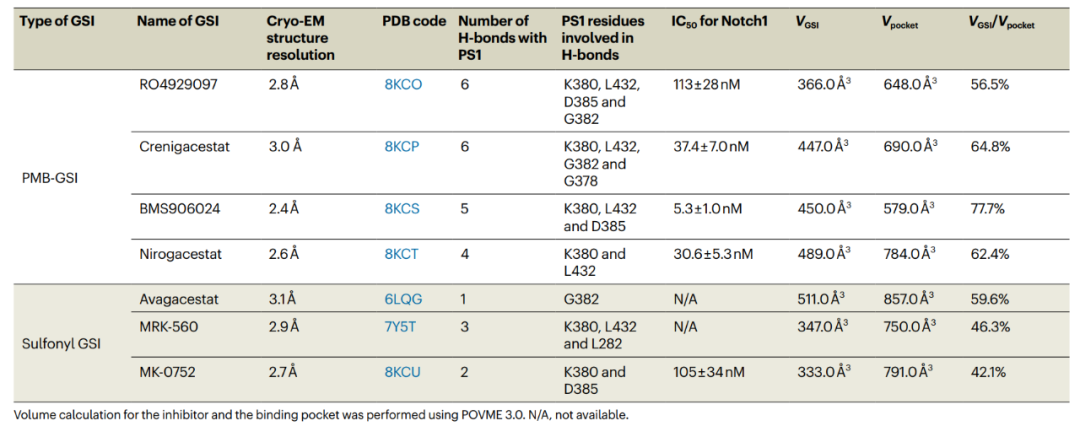
表1. γ-分泌酶识别GSI相关参数的总结
研究团队还分别解析了5种小分子药物结合γ-分泌酶的原子分辨率结构,对其氢键、范德华力等相互作用进行详细地描述和分析,如表1所示。依据其分子结构,这些GSI被分为两种类型:1)RO4929097、Crenigacestat、BMS906024、Nirogacestat,与之前研究的L685,458、Semagacestat,都具有多肽的特征,被归纳为拟肽类GSIs。这类GSI在结构上均表现为典型的β-strand特征,与PS1形成β-sheet结构;2)MK0752,与之间报道的Avagacestat、MRK-560,被归纳为Sulfonyl GSIs,这类小分子往往承担着更多的选择性抑制效果,包括底物选择性和PS1亚型选择性。
然而,氢键以及范德华力相互作用似乎都不能决定这些GSI的抑制效果。研究团队发现BMS906024非常紧密地结合在PS1的口袋中,而这一GSI具有最强的抑制效果,因此作者推测小分子占据结合口袋的比例可能决定了其抑制效果。随后,作者利用POVME 3.0对小分子的体积(VGSI)以及其所诱导形成的特异性口袋的体积(Vpocket)进行精确的计算,并计算了其比值VGSI/Vpocket,如表1和图1a所示。果不其然,VGSI/Vpocket与抑制效果具有非常强的相关性。
这一结论为后续GSI的改造提供了一种明确的优化策略:通过在GSI分子中增加化学基团来提高VGSI/Vpocket。该研究共确定了四个空间位置site 1-4可以用于GSI的化学修饰,如图1b所示。他们还对site 3进行改造测试,验证了这一改造策略的正确性,如图1c、d所示。
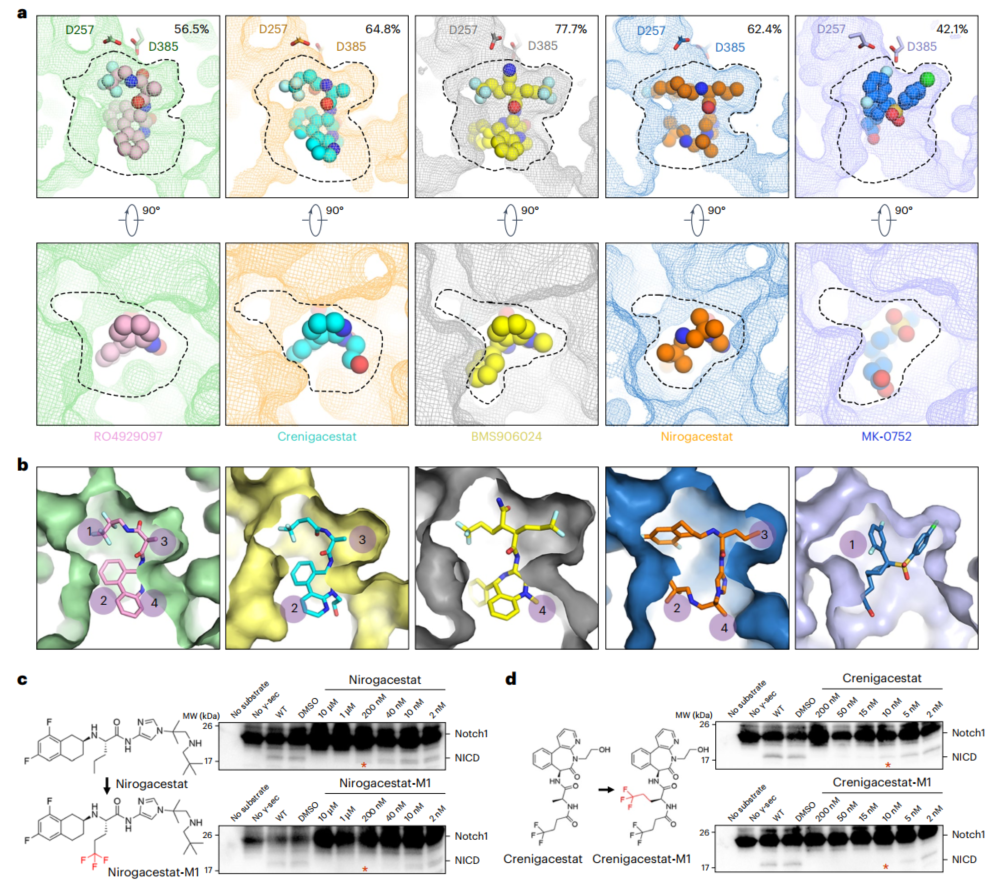
图1. 对5种GSI VGSI/Vpocket的分析以及GSI的改造策略
西湖大学/清华大学生命学院施一公教授和清华大学生命学院副研究员周瑞博士是该研究论文的通讯作者。清华大学生命学院博士后郭雪飞和副研究员周瑞是该论文的共同第一作者。清华大学生命学院博士生李浩田、交流学生Kaicheng U和博士后刘昊参与了本项工作。西湖大学生命科学学院研究员黄晶博士和博士后鲁晓莉对小分子空间计算提供了帮助。清华大学生命学院副教授闫创业博士和冷冻电镜平台主管雷建林博士分别对模型搭建和数据收集提供了指导。该研究得到了北京生物结构前沿研究中心(清华)、科技部国家重点研发计划、国家自然科学基金和浙江省重点研发计划的资助。
相关阅读:
2024年6月6日,西湖大学施一公院士、清华大学生命科学学院周瑞等人在 Science 期刊发表了题为:Molecular mechanism of substrate recognition and cleavage by human γ-secretase 的研究论文。
该研究确定了人γ-分泌酶分别与APP-C99、Aβ49、Aβ46和Aβ43结合的原子分辨率的冷冻电镜(cryo-EM)结构,描述了人类γ-分泌酶在淀粉样前体蛋白(APP)切割过程中如何与不同的Aβ肽底物相互作用,阐明了γ-分泌酶如何产生不同长度的Aβ肽,这些发现将加深我们对淀粉样蛋白生物学的理解,并有助于开发治疗阿尔茨海默病的策略。

论文链接:
https://www.nature.com/articles/s41594-024-01439-8
https://www.science.org/doi/10.1126/science.adn5820
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


